- チオールの酸化反応を紹介
- アルキルチオールとアリールチオールで酸化反応の方法が違う
チオールを酸化するとジスルフィドが生成する反応は、教科書的にはありふれた反応です。ただ、実際に実験をする場合、どうやってジスルフィドを合成するのでしょうか?
今回はチオールからジスルフィドを合成する反応を紹介します。
Contents
そもそもチオール・ジスルフィドって?
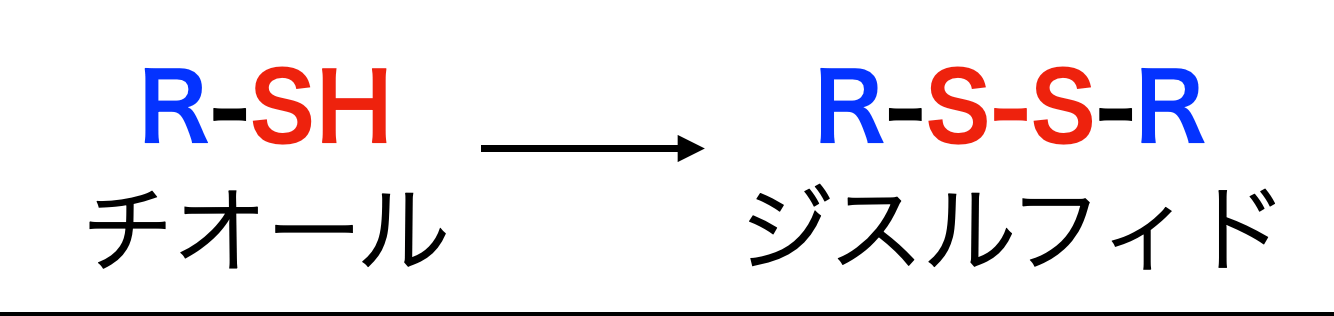
反応の前に、最初にチオール・ジスルフィドの構造式について説明します。チオール、ジスルフィドはそれぞれ下のような構造式です。
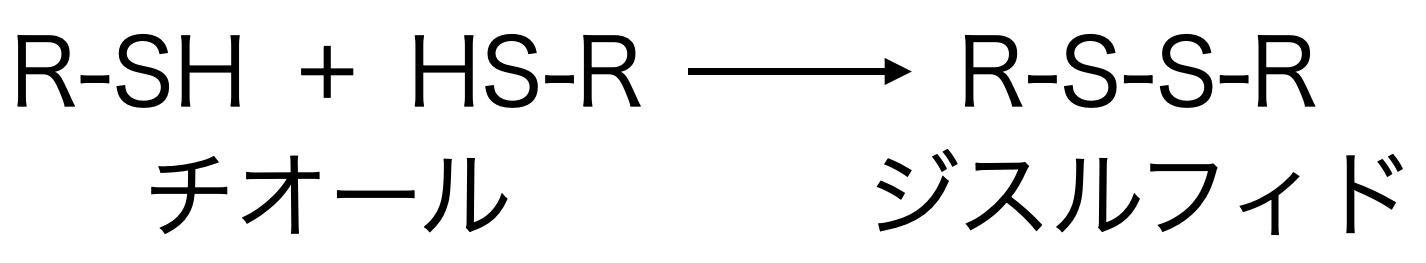
2つのチオールから水素原子がなくなり、硫黄原子同士で結合が形成されたものがジスルフィドです。
余談ですが、2つの炭素鎖が硫黄原子を介してつながった化合物はそれぞれ次のような名前です。
①硫黄原子1個→スルフィド
②硫黄原子2個→ジスルフィド
③硫黄原子3個→トリスルフィド
④硫黄原子4個→テトラスルフィド
スルフィドの前に個数を示す接頭辞をつけていくだけの単純なネーミングです。トリスルフィド以上はほぼ見る機会はないですね。僕も10年以上、大学の研究に身を置いてきましたが、5回以下しか見たことがありません。
逆に言えば、トリスルフィド、テトラスルフィドを使った新しい反応や物性を見つけられれば、独自の研究テーマになる可能性が高いですね。
アルキルチオール→アルキルジスルフィド
アルキルチオールからアルキルジスルフィドを合成する場合、一般的には酸化剤を使います。過酸化水素やヨウ素が、安価で取り扱いもしやすいため、よく使われるそうです。(僕自身は実験をしたことがないので、人から聞いた程度ですが・・・)
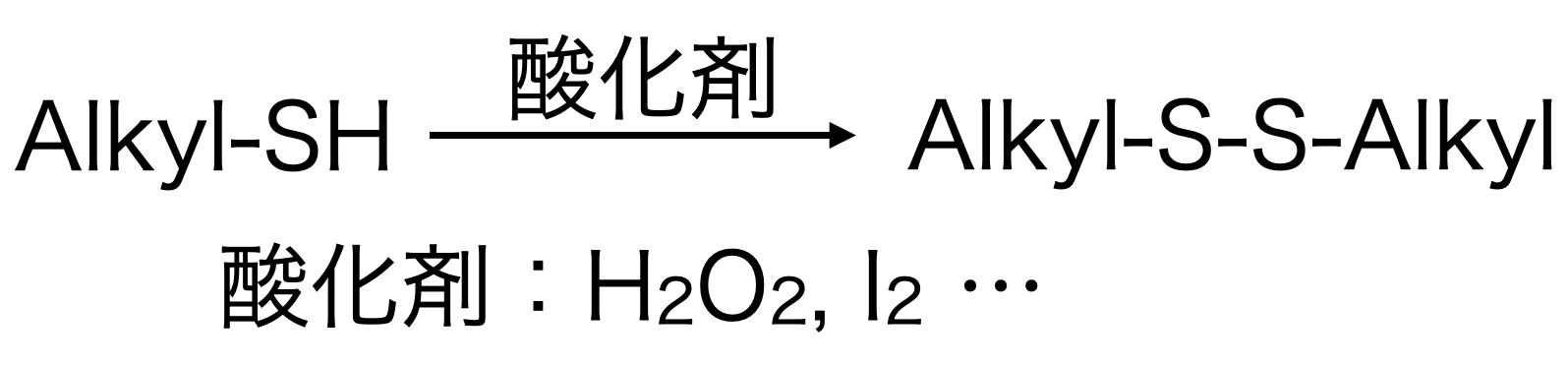
溶媒、温度といった条件は、チオールや酸化剤によって変わります。特に硫黄原子の周りの立体の影響が大きいです。立体的に混み合った分子だと反応が遅くなる傾向にあります。
結論としては、アルキルチオールの場合、分子構造によって反応の条件が変わります。
アリールチオール→アリールジスルフィド
実験手順
アリールチオールの酸化は、上記のアルキルチオールと比べて、とても簡単です。(以下、アリールチオール、アリールジスルフィドは、単にチオール、ジスルフィドと書きます)
手順は下のとおりです。
①チオールを必要な分だけ量り取って、ガラス容器に入れる
②DMSOを適当量だけ入れて、チオールを溶かす
③一晩、空気中で撹拌する
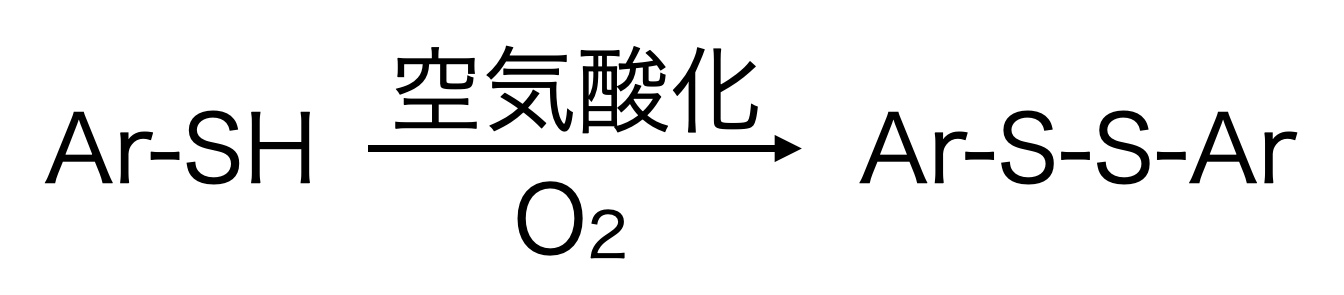
これだけです。たったこれだけですが、収率は90%前後でジスルフィドが生成します。アリール基上の置換基の影響もほぼ受けません。
DMSOの量は?
②の適当量というのが、実験する人からすると、困る書き方だと思うので、補足しておきます。
今回のテーマの酸化反応は、チオール2分子が反応する分子間反応です。つまり、反応溶液の濃度が高いほうが、反応速度は上がります。一方、実験スケールによってはきちんと撹拌ができないと、そもそも反応が進行しないこともありえます。
そのため、DMSOの適当量というのは、きちんと撹拌ができる最低限の量ということになります。DMSOが多すぎると、反応が遅くなりますし、反応後のDMSO除去も面倒になります。私が実験していた1 ~ 5 mmolスケールでは、DMSOの量は1 mL程度でした。
ポイントは、実験に使うガラス器具を小さめのものにすること・激しく撹拌することですね。バイアルや試験管のような断面積の小さい器具で、空気が溶液と混ざるように泡立つくらいで撹拌すると空気酸化が効率よく進行します。

まとめ
チオールを酸化してジスルフィドを合成する反応を紹介しました。
アルキルチオールに比べて、アリールチオールの方が空気酸化できるので、非常に簡単です。アルキルチオールの空気酸化も報告例はありますが、金属や塩基の添加が必要です。
ジスルフィドを実験で使う機会がある人はかなり少ないと思いますが、もし機会があれば、試してみてください。