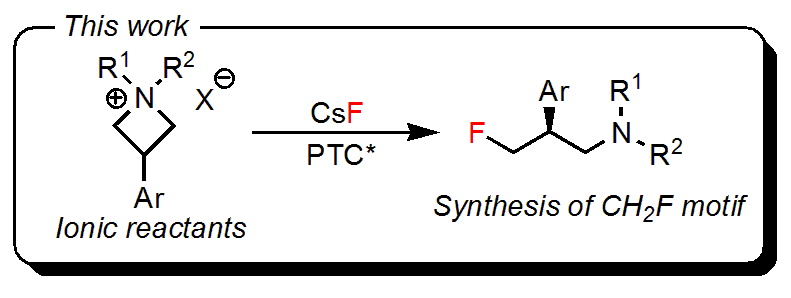
どんな論文?
・相間移動触媒は水素結合を利用し、2つのイオン性の化合物を原料として使える
・アゼチジウム塩のN上の置換基によって、反応性は変わるが、配座は影響しない
Hydrogen Bonding Phase-Transfer Catalysis with Ionic Reactants: Enantioselective Synthesis 𝛾-Fluoroamines
Giulia Roagna, David M. H. Ascough, Francesco Ibba, Anna Chiara Vicini, Alberto Fontana, Kirsten E. Christensen, Aldo Peschiulli, Daniel Oehlrich, Antonio Misale, Andreś A. Trabanco, Robert S.Paton, Gabriele Pupo*, and Veŕonique Gouverneur*
(University of Oxford)J. Am. Chem. Soc. 2020, 142, 14045-14051.
Contents
イオン性の原料を使ったのがすごい!
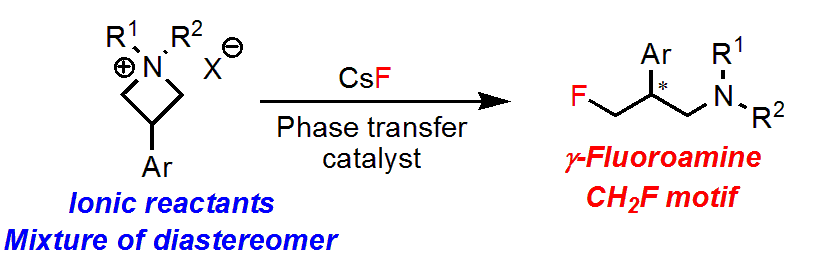
これまでの相間移動触媒を用いたすべてのフッ素化反応では、フッ素源にはイオン性の基質(塩)が用いられていましたが、反応する有機分子は非イオン性の基質(𝛽-ケトエステル、アルケンなど)が用いられていました。
フッ素源だけでなく、原料(反応基質)もイオン性の化合物を使うのは初めての例です。
先行研究
その発展として、アゼチジウム塩の非対称化を伴う𝛾-フルオロアミンを合成することにしました。高エナンチオ選択的な𝛾-フルオロアミンの合成法は少なく、特にCH2F基の合成例はほぼありませんでした。
今回、軸不斉ウレア、アルカリ金属-フッ素塩とアゼチジウム塩による水素結合形成とイオン交換が同時に起こり、つづくC-F結合形成で𝛾-フルオロアミンが得られることを明らかにしました。
相間移動触媒とフッ素アニオンの安定化がキモ
アゼチジウム塩-CsF vs 相間移動触媒-CsFの相互作用
今回の反応では、アゼチジウム塩、フッ化セシウム(CsF)、相間移動触媒が溶媒中に存在します。その中から、はじめにCsFと相間移動触媒が相互作用し、続いてアゼチジウム塩と反応することで𝛾-フルオロアミンが生成します。
ということは、混合物の中から、CsFとアゼチジウム塩は相互作用せず(あるいは弱い相互作用をし)、CsFと相間移動触媒が相互作用することが必要です。
しかし、一般的にアミン塩やピリジニウム塩(カチオン)はフッ素アニオンと塩を形成します。
実際に、そういった塩はイオン性液体となり、相間移動触媒として利用されることもあります。
CsFとの相互作用による安定化エネルギーの差
今回のアゼチジウム塩はフッ素アニオンと塩形成して、反応が止まるということはないのでしょうか?
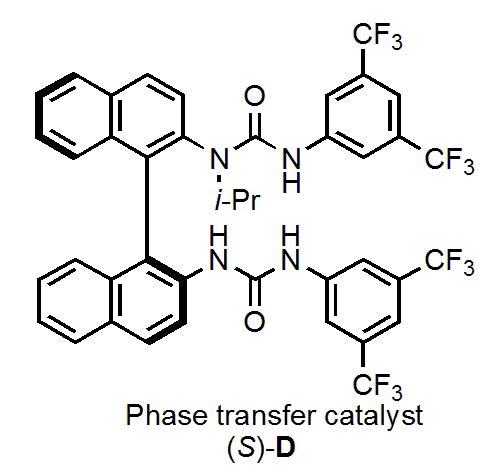
フッ素アニオンと、軸不斉ウレア(相間移動触媒)またはアゼチジウム塩による塩形成(1,2-ジクロロエタン中)のエネルギーを計算すると、それぞれ-69kJ/mol, -14kJ/molとなりました。
つまり、フッ素アニオンは軸不斉ウレアと塩形成した方が安定であり、アゼチジウム塩の存在下、軸不斉ウレアを触媒として利用できることが示されました。
アゼチジウム塩の非対称化によるエナンチオ選択的𝛾-フルオロアミンの合成
反応条件と基質検討
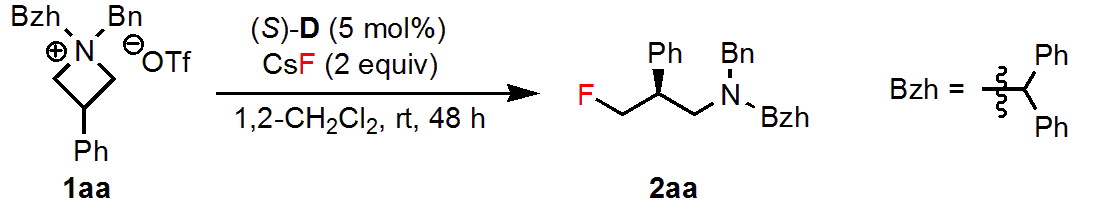
触媒、基質の構造を含む反応条件の最適化からはじめました。
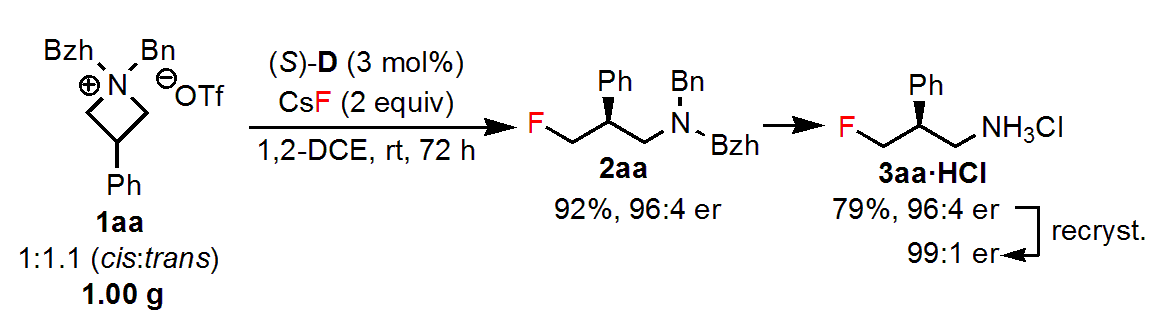
触媒とアゼチジウム塩それぞれのN上の置換基や溶媒などを検討した結果、1aaを原料とし、相間移動触媒(S)-D存在下、1,2-ジクロロエタン中で反応を行うのが最適条件でした。この条件で、目的の𝛾-フルオロアミン2aaは98%収率、96:4 erで得られました。
基質検討では、数多くの基質で、高収率、高エナンチオ選択性で目的の生成物が得られていて、アゼチジウム塩の3位にはさまざまな置換基を導入できています。ただし、アルキル基が1つであったり、2つともアルキル基の場合は、生成物があまり得られていません。
ベンズヒドリル基で反応性アップ
3位にベンズヒドリル基をもつアゼチジウム塩を使うことで、以下のような2つの利点があります。
②アゼチジウム塩のN上の置換基はベンズヒドリル基とベンジル基なので、簡単に脱保護して、第1級アミンが得られます。そこからの変換も容易にできます。
スケールアップと医薬品合成
この反応は1gスケールまで上げても、収率やeeの低下はなく、目的の生成物が得られました。スケールアップにより触媒量は3mol%に減らしても大丈夫でした。
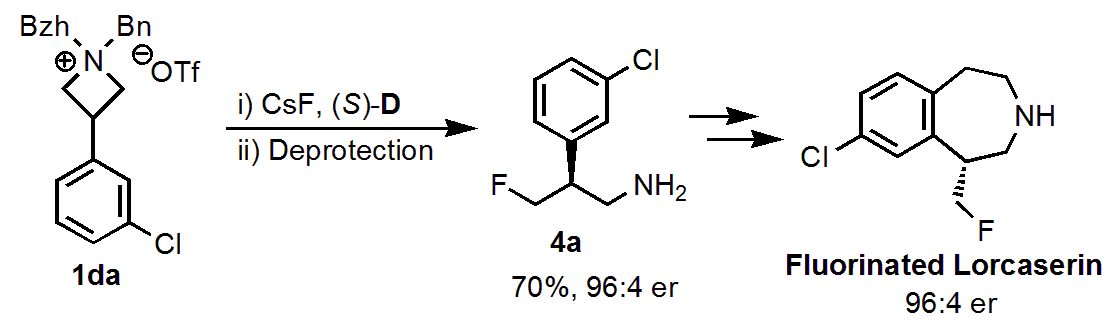
また、ロルカセリン(選択的セロトニン受容体アゴニスト)のモノフッ素化体の合成も比較的簡単にできています。
反応メカニズムの検証
対照実験
水が存在する条件下やアゼチジウム塩のアニオンを変えたりして、反応の結果を調べています。そういった条件を変更すると、収率が低下するという実験結果が得られました。
また、触媒の光学純度と得られる生成物の光学純度に線形の相関があったことから、触媒1分子だけが反応に関与していると考えられます。
DFT計算
DFT計算により、cis-1aでキラル発現過程について計算してみました。
(ii)アゼチジウム塩の分子内CH-𝜋相互作用
(iii)ベンズヒドリル基と触媒のナフチル基との𝜋-𝜋相互作用
これらの3つの相互作用が、遷移状態の安定化に寄与しているそう。trans-1aもcis-1aとほぼ同じ立体構造をとるため、ジアステレオマー混合物を原料としても、単一の光学異性体が得られたそう。
(transとcisで1点だけ違いがあり、それは生成物のN上の置換基の向きが理論上異なるとのこと。しかし、反応後の第3級アミンであればフリップするので配座は関係なくなり、この反応の生成物の光学純度には影響しなくなるそう)