どんな論文?
・ヘテロ環を持つアシル化合物のβ位水素の活性化から反応が始まる
・原子効率の良い反応で副生成物は水だけ
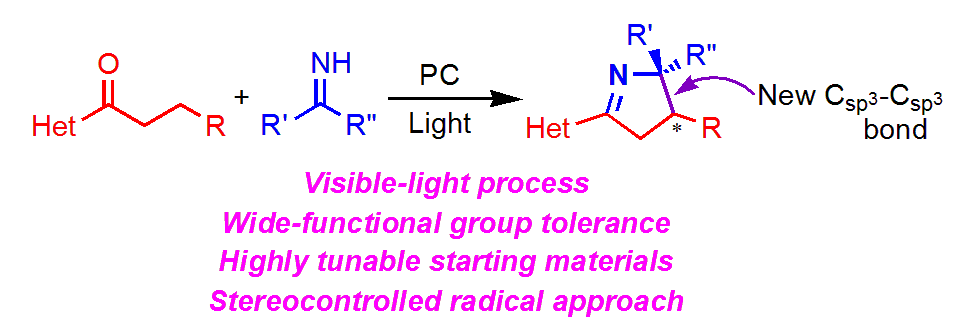
Light‐Driven Enantioselective Synthesis of Pyrroline Derivatives by a Radical/Polar Cascade Reaction
Ricardo I. Rodríguez, Leonardo Mollari and José Alemán*
(Universidad Autónoma de Madrid)Angew. Chem. Int. Ed. Early View.
Contents
光によるエナンチオ選択的なピロリン合成がすごい!
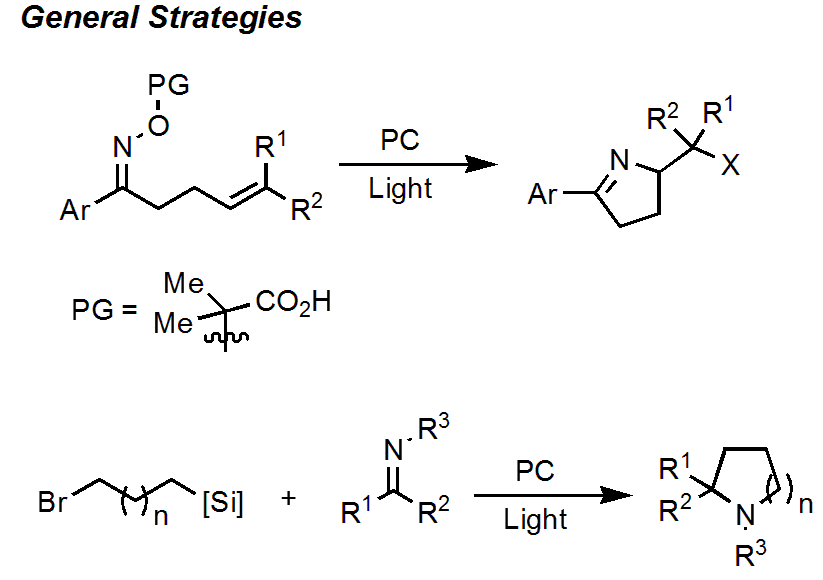
ラジカル的なピロリン誘導体の合成例は、ラジカル発生源によって、次の2つのアプローチがあります。ただし、どちらの報告例もラセミ体合成であり、かつ脱離基を必要するもので、原子効率が良くないといった改善点がありました。
1つはオレフィンを持つオキシム誘導体を用いる方法。この反応では、光によってN-O結合が切断されて、ラジカルが発生し、オレフィン(や他の分子)とのラジカルカップリングへと続き、最終的にピロリンが生成します。
2つ目はアルキルシランの光によるラジカル化と続くイミンとのラジカルカップリングによる反応です。
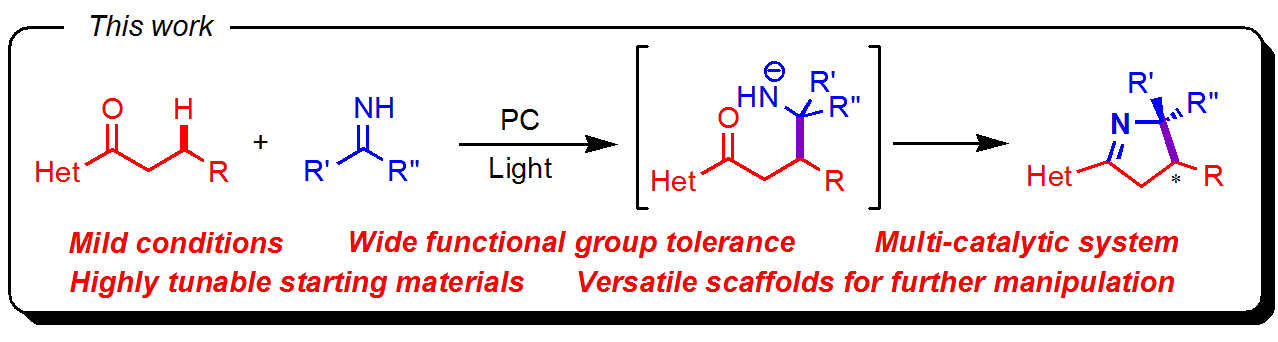
著者らはアシル基とヘテロ環に配位する不斉ロジウム触媒を用いることで、エナンチオ選択的なピロリン合成を達成しました。
基質設計での着目点
著者らが基質デザインで意識したのは下の2点。
・アシル基・ヘテロ環と離れた位置でのCsp3ラジカルの発生およびケトイミンとのカップリング
・1,5位での分子内環化による5員環形成
上記2点に加え、以下の点も気をつけて、基質、反応剤を選択しました。
1a:β位C-Hの結合乖離エネルギー(BDE)がエノール化することで低くなる(Ref 12e)
ケト形→76 kcal/mol(316 kJ/mol) エノール形→58 kcal/mol(243 kJ/mol)
2A:合成もしやすく、電子求引性もあるため
塩基:還元電位からDABCO(+0.69 V)またはキヌクリジン(+1.1 V)
本検討
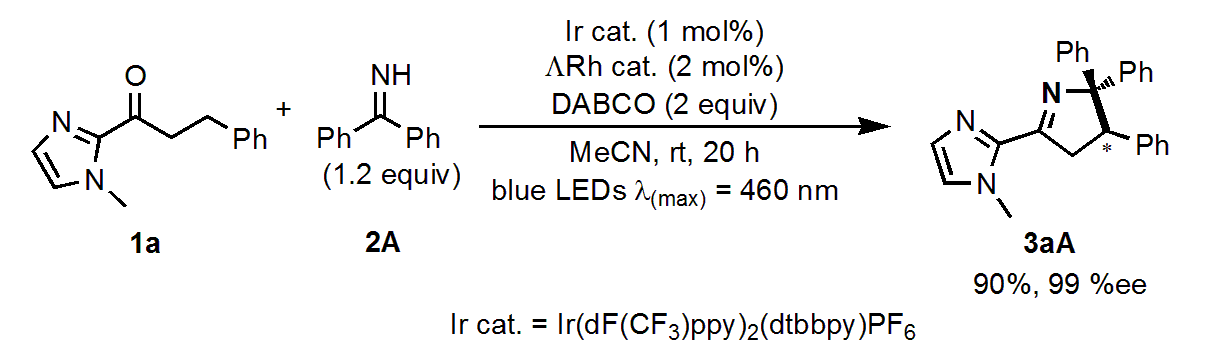
反応条件の検討
反応条件、パラメーターを最適化すると90%収率、99%eeと高収率、高エナンチオ選択性で目的の3aAが得られました。
光触媒、ルイス酸、塩基、光照射のいずれかがない状態では反応が進行しなかったため、これらは反応に必須であることも示しました。
DABCOを触媒量まで減らすと収率が66%まで低下しました。なので、DABCOは塩基としてだけでなく、HAT(水素移動)にも関与していると考えられます。
また、Stern-VolmerプロットからDABCOで消光していることが明らかとなり、メカニズムの考察に移りました。
推定メカニズムは本文Scheme2の通り。イミンラジカルアニオンとIIのカップリングはScheme2ではラジカルーラジカルカップリングで書かれているが、著者らはラジカルとアニオンのクロスオーバーの可能性も高いと考えている。というのも、イミンのホモカップリング体(1,2-ジアミン)や還元体が検出されないため。
基質検討
ベンジル基を変えても、概ね高収率、高エナンチオ選択的に目的物が得られた。スケールアップもOK。
ベンジル位よりもC-H結合が強いアリル位、プロパルギル位の場合、イミンの当量を増やし、反応時間を延ばすと良好な収率、エナンチオ選択性で反応が進行しました。
イミダゾールをピリジンに変えたり、イミンの片方のフェニル基を一部のアルキル基(t-Bu,CF3)に変えても反応結果は良好でした。著者らの考察では、エナミン型になれるアルキルイミン(α水素を持つイミン)は反応に向いてなさそうとのことです。
非対称イミンを使うと、生成物にはジアステレオマーが生成しますが、ジアステレオ選択性はあまりよくないとのことです。ここの改善が今後の課題とのこと。
この反応の応用
生成物の変換(水素化、Grignard試薬の付加、チオトリフルオロメチル基の付加)も問題なく進行しています。