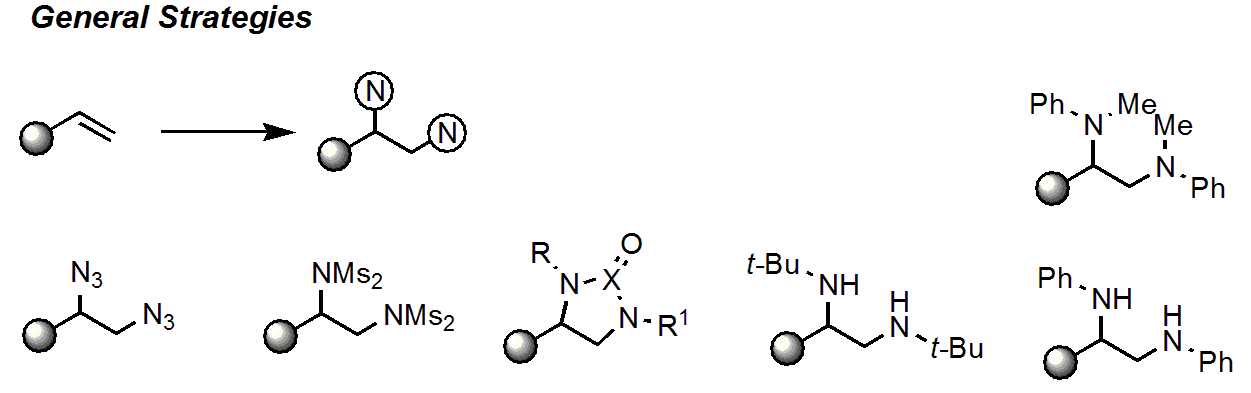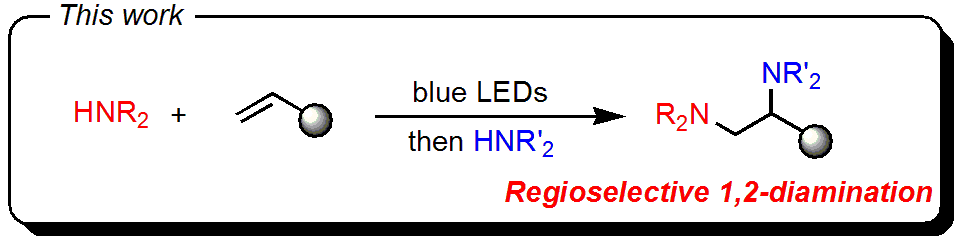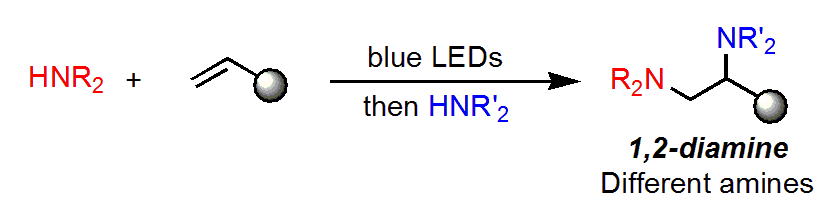
どんな論文?
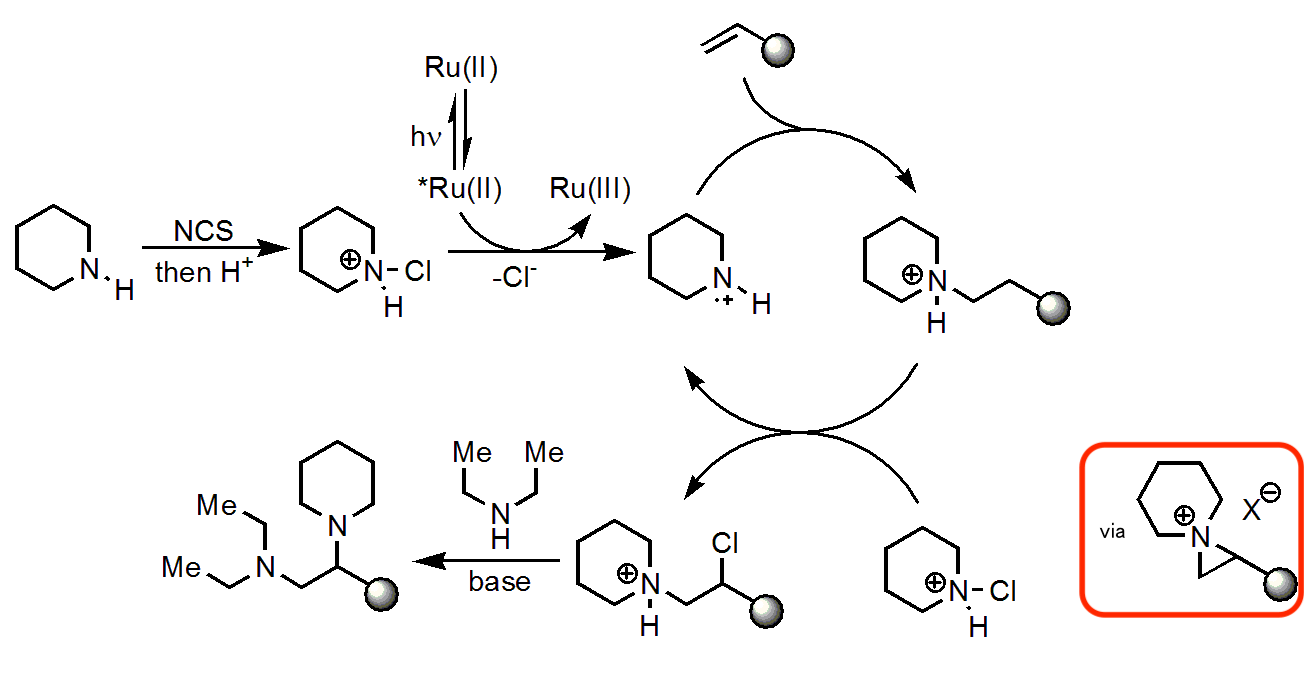
・N-クロロアミンが光により活性化されて生じるアミニウムラジカルが反応において重要
・オレフィンに対して、段階的にアミンが反応することで、1,2-ジアミンが単一の生成物として生成する
Photoinduced Olefin Diamination with Alkylamines
Sebastian Govaerts, Lucrezia Angelini, Charlotte Hampton, Laia Malet-Sanz, Alessandro Ruffoni*, and Daniele Leonori*
(University of Manchester, Eli Lilly and Company Limited)Angew. Chem. Int. Ed. 2020, 59, 15021-15028.
Contents
位置選択的1,2-ジアミン合成がすごい!
アルケンから1,2-ジアミンの合成は、さまざまな反応が報告されていますが、これまでの例では直接的な合成がなかったり、重金属を当量以上使うなどの改善すべき点がありました。
さらに、アルケン:窒素源=1:2で反応させるため、生成物の1,2-ジアミンはN上の置換基が同じものとなります。すなわち、異なる置換基をもつ窒素源をアルケンに付加させることは困難でした。
従来、N上に異なる置換基をもつ1,2-ジアミンを合成するには、エポキシドやα-ブロモケトンなどを出発原料として、数段階をかける必要がありました。
しかし、今回、著者らは異なる2種類のアミンの直接的かつ位置選択的なオレフィンへの付加反応を開発しました。
先行研究
2段階の反応による1,2-ジアミン合成
今回の論文のタイトルであるオレフィンのジアミノ化ですが、大きく分けて2段階の反応です。
ここで想定メカニズムを示します。
1段階目で1分子のアミンとNCSによるクロロアミノ化と続くオレフィンへの付加が起こり(想定メカニズムの上段)、2段階目に塩素原子ともう1分子のアミンの置換が起こります(想定メカニズムの下段)。その結果、1分子のオレフィンに対し、2分子のアミンが付加した形となります。
そのため、1分子のアミンとオレフィンの反応(クロロアミノ化)、塩素とアミンの置換反応の2段階で説明します。
研究背景:β-クロロアミンの合成
N-クロロアミンをオレフィンに付加させる反応は1960年代にも報告されていますが、強酸を溶媒に使ったり、高エネルギーのUVライトを使うなど、条件がきついものでした。
近年、金属触媒存在下、N-クロロアミンをオレフィンに付加させて、β-クロロアミンを合成する反応が報告されています。そこから修飾することで、さまざまなβ-官能基化されたアミンを合成しています。
しかし、そういった報告ではPivO-NH2や8-アミノキノリンのような配向基を持つ原料が必要で、未だに配向基のような特別な官能基をもたないアルキルアミンやオレフィンを用いたβ-クロロアミンの合成は知られていません。
クロロアミノ化の検討
反応条件の検討
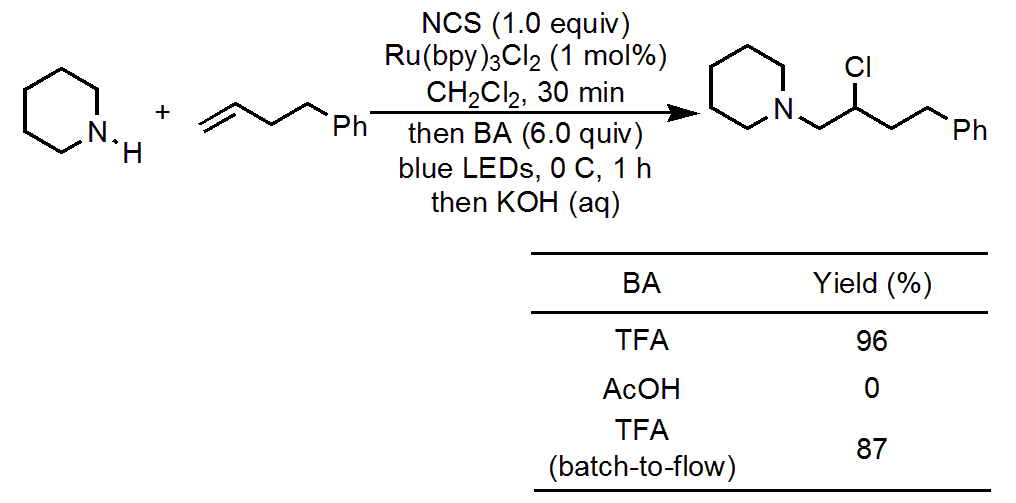
反応条件の検討として、はじめに溶媒とBrønsted酸の検討を行いました。
溶媒はここでは割愛しますが、Brønsted酸は非常に重要で、ある程度の酸の強さ(pKa)がないと反応が進行しなくなりました。
具体的にはTFA (pKa = -0.25)であれば90%以上の収率で反応が進行しましたが、酢酸 (pKa = 4.76)では反応が進行しませんでした。
これは、推定メカニズムで、はじめのプロトン化と続くSETに関係していると考えられます。
*Ru(II)の酸化電位は-0.81 Vですが、N-クロロピペリジンの還元電位は-1.80 Vのため、SETは吸熱過程 = 反応が進行しにくいです。そのため、反応の出発物質であるプロトン化されたN-クロロピペリジンが生成しやすくするように、強酸を加えています。
フロー式での反応も検討し、条件を最適化したところ、講習率で反応時間の短縮ができました。
基質検討
アミン、オレフィンの基質検討を行いました。(詳しくは論文のScheme 3を参照)
多くの反応基質で問題なく反応しています。カルボニル基、ヒドロキシ基を持った第2級アミンやオレフィンでも高収率で対応するアミンが得られています。その他、2置換オレフィンや保護されたアミン部位を持つオレフィンも大丈夫です。
また第1級アミンも対応する付加体が得られています。(アミン:オレフィンが1:1の付加体しか得られていないのは反応条件を調節した?)
1つの分子内に2つのオレフィンを持つ場合、電子密度が高いほうのオレフィンだけが選択的に反応したそう。
この反応は官能基許容性が高く、オレフィンの選択性も高いので、合成の終盤でも使える反応となりえそうです。
スチレン誘導体は塩素置換では止まらない
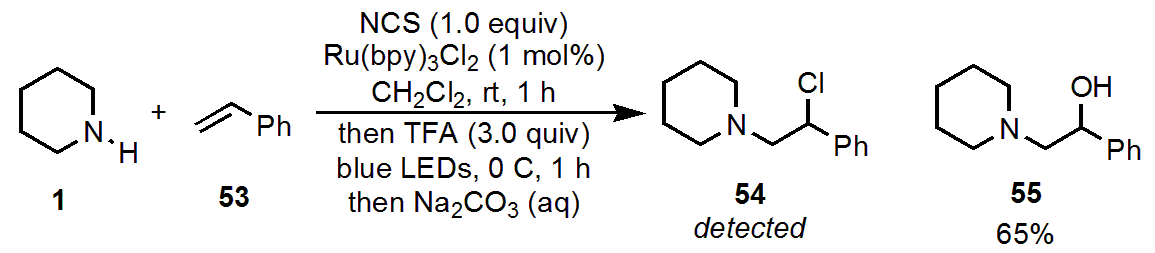
基質検討のなかで、スチレン誘導体だけが他と違う結果となりました。
ピペリジン1とスチレン53を反応させると、主生成物はアミノアルコール55となりました。どうして、55のようなアルコールになってしまったのでしょうか?
crudeのLCMS測定で、クロロアミノ化された54も検出されているため、著者らはクロロアミノ化反応自体は問題なく進行していると判断しました。塩化ベンジルという反応性の高い構造を持っているため、塩基性条件での反応停止時に加水分解したのだろうと考えられます。
2つ目のアミンの置換反応
アジリジニウム塩形成と求核的開環反応
クロロアミノ化が達成されたので、次に、2つ目のアミンの置換反応に移りました。
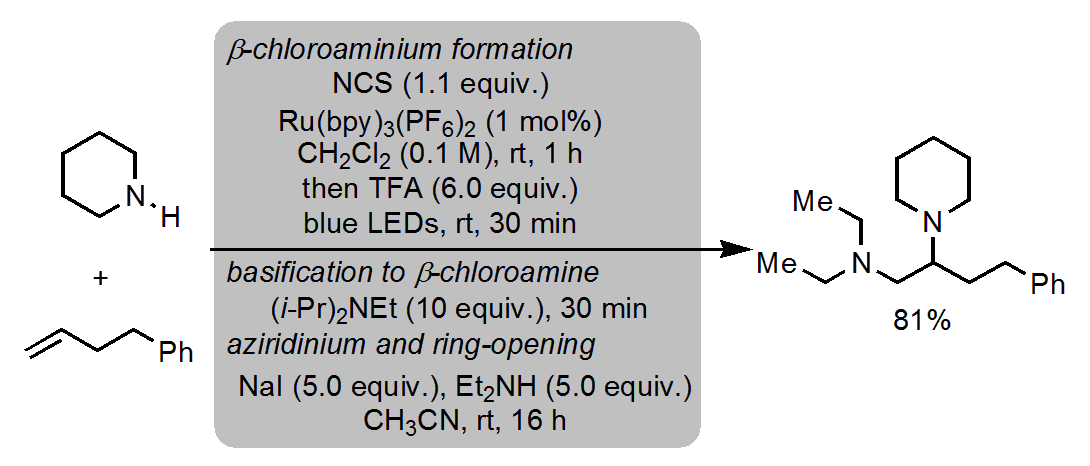
ここでは、1段階目の生成物(β-クロロアミン)が系中でアジリジニウム塩を形成することが必要です。
しかし、重アセトニトリル中、β-クロロアミンは室温で安定で、全く変換しませんでした。そこで、添加剤を加えたところ、AgBF4またはNaIの添加で、アジリジニウム塩の形成が進行しました。ここの変換速度は遅いものの、完全に塩形成が進行するNaIが最適な添加剤となりました。
その後、ジエチルアミンを添加してみると、目的の置換反応が進行しました。この結果、オレフィン1分子に対して、異なる2分子のアミンが付加した形の1,2-ジアミンが得られました。
最終的に、One-potでオレフィンから1,2-ジアミンを合成できるようにしました。
反応スキームの通り、①〜③の順に作用させると、反応がうまく進行しました。
①NCS、Ru(bpy)3(PF6)2; TFA, blue LEDs
②(i-Pr)2NEt
③NaI, R2NH
NaIでアジリジニウム塩形成が進行しやすくなっていることから、NCSの代わりにNISやNBSを用いることで、NaIを添加しなくても塩形成が進行すると著者らは考えました。しかし、この予想は外れて、NIS、NBSでは反応が全く進行しなかったそうです。
One-pot反応の基質検討
このOne-pot反応は多くのアミンで問題なく反応が進行してます。
スチレン誘導体を原料に使った場合、アミノアルコールが生成する副反応が起きる問題がありました。
これは反応後のワークアップで、(i-Pr)2NEtではなく、Na2CO3存在下に2つ目のアミンを添加することで、対応する1,2-ジアミンが効率的に生成しました。
この反応の応用
トリアルキルアジリジンの合成
今回の反応を応用すると、トリアルキルアジリジンの合成が1段階でできるようになりました。
1段階目のアミンの付加のときに第1級アミンを使い、塩基処理後にNaIを添加すると、アジリジニウム塩ではなく、アジリジンとなり、そこで反応が止まります。
トリアルキルアジリジンの合成には、複数工程が必要なものばかりであったので、今回のように1段階で合成できる反応は非常に有用とのことです。
他の官能基の導入
2つ目のアミンによる求核的開環反応の段階で、他の求核剤を使うことで、様々な官能基の導入ができるようになりました。すなわち、アミンと隣接する官能基を持つ分子の合成が自在にできるようになりました。